
Les thématiques de recherches et laboratoires associés
Laboratoire de Recherche Nanotranslationnelle – Alexandre Detappe
Mécanismes moléculaires et intervention thérapeutique ciblée pour la Neuroprotection – Dominique Bagnard
Chémogénomique et Chimie Médicinale – Frédéric Bihel
Interactions du microenvironnement immun dans la santé et les pathologies – Christopher Mueller
Chimie Biologie Intégrative et Pharmacognosie – Dominique Bonnet
Chimie Biofonctionnelle – Alain Wagner
Poly(ADP-ribosyl)ation et intégrité du génome – Françoise Dantzer
Plateforme de chimie biologique intégrative de Strasbourg – Pascal Villa
Neuroimmunologie et thérapie peptidique – Sylviane Muller
Neuroimmunologie et thérapie peptidique – Sylviane Muller
Interactions du microenvironnement immun dans la santé et les pathologies – Christopher Mueller
Chimie Biologie Intégrative et Pharmacognosie – Dominique Bonnet
Chémogénomique et Chimie Médicinale – Frédéric Bihel
Plateforme de chimie biologique intégrative de Strasbourg – Pascal Villa
RCPG, Douleur et Inflammation – Frédéric Simonin
Chimie Biologie Intégrative et Pharmacognosie – Dominique Bonnet
Chémogénomique et Chimie Médicinale – Frédéric Bihel
Plateforme de chimie biologique intégrative de Strasbourg – Pascal Villa
Neuroimmunologie et thérapie peptidique – Sylviane Muller
Mécanismes moléculaires et intervention thérapeutique ciblée pour la Neuroprotection – Dominique Bagnard
Chémogénomique et Chimie Médicinale – Frédéric Bihel
Plateforme de chimie biologique intégrative de Strasbourg – Pascal Villa
Neuroimmunologie et thérapie peptidique – Sylviane Muller
Chémogénomique et Chimie Médicinale – Frédéric Bihel
Plateforme de chimie biologique intégrative de Strasbourg – Pascal Villa
Chémogénomique et Chimie Médicinale – Frédéric Bihel
Plateforme de chimie biologique intégrative de Strasbourg – Pascal Villa
Imagerie Moléculaire – Frédéric Boisson
Plateforme de chimie biologique intégrative de Strasbourg – Pascal Villa
Spectrométrie de Masse BioOrganique – Sarah Cianférani
Les laboratoires de recherche
Laboratoire de Recherche Nanotranslationnelle
Le laboratoire de recherche du Pr. Alexandre DETAPPE est situé à l’Institut de Cancérologie Strasbourg Europe (ICANS) et est affilié au CNRS UMR7178 et à l’ITI Institut du Médicament Strasbourg. L’équipe travaille sur :
- des méthodes de traitement innovantes pour diminuer les toxicités induites par les chimiothérapies,
- l’utilisation de la nanomédecine pour moduler les réponses immunitaires,
- le développement de biomarqueurs d’imagerie pour comprendre les réponses thérapeutiques et immunitaires aux nouvelles thérapies anti-cancéreuses.
Plus spécifiquement, nous développons de nouvelles approches de délivrance ciblées de médicaments, d’immunothérapies couplées à la nanomédecine, la synthèse de nouveaux anticorps chargés, et de nouvelles molécules thérapeutiques. Notre expertise est basée sur leurs applications en hémato-oncologie (myélome multiple) et le cancer du sein.
Cependant, nous sommes ouverts à toutes autres collaborations dans d’autres domaines de la cancérologie. Notre but est de promouvoir chacun de nos essais précliniques en essai clinique, avec pour but ultime d’améliorer la qualité de vie de nos patients.
UMR 7178 CNRS-Unistra, Institut de Cancérologie Strasbourg Europe (ICANS),
17 Rue Albert Calmette, 67200 Strasbourg
a.detappe (at) icans.eu
Neuroimmunologie et thérapie peptidique
Le laboratoire de recherche du Pr. Sylviane Muller est localisé à l’Institut de science et d’ingénierie supramoléculaire (ISIS) à Strasbourg. Il dépend de l’UMR 7242 CNRS-Université de Strasbourg Biotechnologie et signalisation cellulaire (Ecole supérieure de biotechnologie de Strasbourg). Sylviane Muller co-anime l’équipe Neuroimmunologie et thérapie peptidique dont l’activité de recherche est centrée sur la compréhension des défauts immunitaires rencontrés au cours de maladies autoimmunes et inflammatoires et leur correction par des voies thérapeutiques spécifiques personnalisées et contrôlées. Plus précisément, l’équipe :
- étudie les circuits cellulaires et moléculaires, notamment ceux liés l’autophagie lysosomale, qui sont dérégulés chez l’homme et l’animal dans différentes pathologies inflammatoires ;
- analyse les perturbations comportementales apparaissant progressivement avec l’âge chez des souris modèles de maladies autoimmunes neurologiques ;
- développe des stratégies thérapeutiques ciblées sur les mécanismes cellulaires défectueux. Le peptide P140 découvert dans l’équipe est actuellement évalué dans des essais cliniques de phase III dans le Lupus.
Biotechnologie et signalisation cellulaire (UMR7242 CNRS-Unistra)
300 boulevard Sébastien Brant, CS 10413, 67412 ILLKIRCH CEDEX
sylviane.muller (at) unistra.fr

Responsable :
Dominique Bagnard
Mécanismes moléculaires et intervention thérapeutique ciblée pour la Neuroprotection
L’innovation thérapeutique passe par le décryptage des interactions moléculaires qui régissent le fonctionnement cellulaire afin de pouvoir développer des médicaments capables de moduler ces interactions et corriger leurs dysfonctionnements. Ce concept d’interactions moléculaires prend une dimension particulière avec les protéines membranaires qui assurent l’interface entre le milieu extracellulaire et le milieu intracellulaire site essentiel pour la transmission des signaux contrôlant la cellule. Le laboratoire de recherche du Dr Bagnard travaille au développement de composés peptidiques agissant comme des agents interférents modulant les interactions entre protéines membranaires.
Ces peptides ciblent les domaines transmembranaires des récepteurs membranaires et ont déjà montré leur potentiel thérapeutique pour le traitement de cancers comme le glioblastome ou le cancer du sein métastatique mais aussi dans le cas de maladies démyélinisantes comme la sclérose en plaques. Fort d’une expérience de plus de quinze ans sur cette stratégie unique, le laboratoire a développé un savoir-faire matérialisé par une plateforme de design et d’évaluation préclinique de ces peptides transmembranaires thérapeutiques applicable à toutes formes de composés thérapeutiques.
Depuis l’utilisation de la modélisation in silico jusqu’aux modèles animaux in vivo des pathologies en passant par des modèles in vitro 3D, le laboratoire possède une expertise et des moyens techniques complets pour obtenir des composés brevetables avec un potentiel de transfert élevé. Les travaux menés prennent également en compte la nécessité de disposer d’outils moléculaires pour la prédiction de l’évolution d’une maladie ou de la réponse à un traitement.
Les outils moléculaires développés au laboratoire ont pour objectif d’aider à la validation de traitements expérimentaux tout en contribuant au suivi de la réponse thérapeutique.
INSERM ERL 1321 – Biopathologie de la Myéline, Neuroprotection et stratégies thérapeutiques (Dir : Pr G. Mensah-Nyagan)
Site d’Illkirch Pôle API Bâtiment E – 300 Boulevard S. Brant
bagnard (at) unistra.fr

Responsable :
Sarah Cianférani
Spectrométrie de Masse BioOrganique
Le Laboratoire de Spectrométrie de Masse BioOrganique (LSMBO) est une équipe du Département des Sciences Analytiques de l’Institut Pluridisciplinaire Hubert Curien (IPHC, CNRS Université de Strasbourg UMR7178). Le LSMBO héberge la plateforme protéomique Strasbourg Grand Est (labélisée IBiSA) et est le nœud strasbourgeois de l’Infrastructure Nationale de Protéomique ProFI (www.profiproteomics.fr). Le LSMBO est une équipe de 35 personnes avec plus de 30 ans d’expertise dans l’analyse structurale de peptides et protéines par spectrométrie de masse. L’expertise du LSMBO repose sur des développements méthodologiques en protéomique quantitative, bioinformatique pour la protéomique et spectrométrie de masse structurale pour l’analyse de complexes protéine/protéine de hautes masses. L’équipe dispose d’une expérience de longue date de collaboration avec de nombreuses compagnies pharmaceutiques pour la caractérisation de protéines médicament recombinantes, la toxicoprotéomique ou encore pour la caractérisation d’interactions protéine/ligands.
Expertise :
- Préparation d’échantillons (gel 1D/2D, digestion liquide, enrichissement PTMs…),
- Identification et quantification globale de protéines à très haut débit (label free),
- Quantification ciblée de protéines par LC-SRM/PRM,
- Identification et quantification de modifications post-traductionnelles,
- Analyse bioinformatique des données de protéomique (banques protéiques, séquençage de novo),
- Identification de partenaires de complexes multiprotéiques (interactomique),
- Caractérisation de protéines recombinantes purifiées ou à usage thérapeutique comme les anticorps monoclonaux,
- Analyse structurale de complexes non covalents par MS native et mobilité ionique (complexes multiprotéiques, protéines/ADN ou ARN, et protéines/ligand),
- Echange H/D suivi par spectrométrie de masse, épitope mapping,
- Pontage chimique (cross-linking) de complexes multiprotéiques.
UMR 7178 CNRS-Unistra, Institut Pluridisciplinaire Hubert Curien (IPHC),
23 rue du Loess, BP 28, 67037 Strasbourg Cedex
sarah.cianferani (at) unistra.fr

Responsable :
Frédéric Simonin
RCPG, Douleur et Inflammation
Les récepteurs couplés aux protéines G (RCPGs) représentent la plus grande famille de récepteurs membranaires chez les eucaryotes avec plus de 800 membres chez l’homme. Ils sont stimulés par une grande variété de signaux extracellulaires et sont impliqués dans de nombreux processus physiologiques et physio-pathologiques incluant la neurotransmission, la division et la différentiation cellulaire, la chimiotaxie, l’inflammation et la douleur. A ce titre, ils représentent des cibles privilégiées pour le développement de nouveaux médicaments. Notre équipe s’intéresse particulièrement au rôle de différents RCPG dans le développement de la douleur et les processus inflammatoires associés ainsi qu’aux mécanismes qui régulent la signalisation des RCPG. Nos approches incluent le développement d’outils pharmacologiques (antagonistes) et génétiques (souris KO) pour ces différentes cibles ainsi que de nouvelles stratégies thérapeutiques pour le traitement de la douleur
UMR 7242 CNRS-Unistra, Ecole Supérieure de Biotechnologie de Strasbourg (ESBS)
300 Boulevard Sébastien Brant, 67412 Illkirch
frederic.simonin (at) unistra.fr

Responsable :
Frédéric Bihel & Esther KELLENBERGER
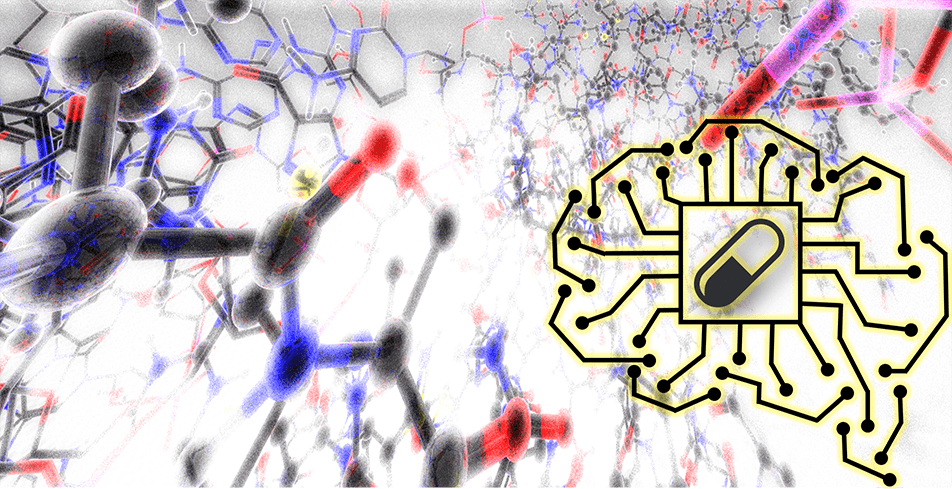
Chémogénomique et Chimie Médicinale
Utilisant les technologies de l’intelligence artificielle ainsi que les concepts de pointe en chimie organique et médicinale, l’équipe CCM conçoit, synthétise et fonctionnalise les châssis moléculaires innovants appliqués à la recherche thérapeutique
UMR 7200 CNRS-Unistra, Faculté de Pharmacie,
74 route du Rhin, 67401 Illkirch, cedex, FRANCE
frederic.bihel (at) unistra.fr

Responsable :
Frédéric Boisson
Imagerie Moléculaire & Radiobiologie
Les activités de l’équipe sont concentrées autour de deux domaines de recherche principaux. Le premier est le développement de dispositifs d’imagerie pour la visualisation in vivo des mécanismes au niveau moléculaire en imagerie préclinique. Notre philosophie est de repousser les limites des solutions commerciales pour rendre accessibles des processus biologiques jusque-là non observés. Le deuxième axe de recherche principal est le marquage de bio-molécules (anticorps, peptides, petites molécules) avec divers isotopes dédiés à l’imagerie TEP et de TEMP.
L’équipe possède toute l’expertise nécessaire au développement instrumental, ainsi qu’à la quantification et au traitement du signal, dans le domaine de l’imagerie, et plus particulièrement des modalités d’imagerie « nucléaire » telles que TEP et TEMP. Cette expertise est d’autant plus forte qu’elle repose entre autres sur les compétences internes en radiochimie au travers du marquage de molécules (anticorps, peptides, macro- et petites molécules) avec divers isotopes dédiés à l’imagerie TEP et TEMP produit grâce au cyclotron Cyrcé.

UMR 7178 CNRS-Unistra; Institut Pluridisciplinaire Hubert Curien (IPHC),
23 rue du Loess, BP 28, 67037 Strasbourg Cedex
frederic.boisson (at) iphc.cnrs.fr

Responsable :
Christopher Mueller
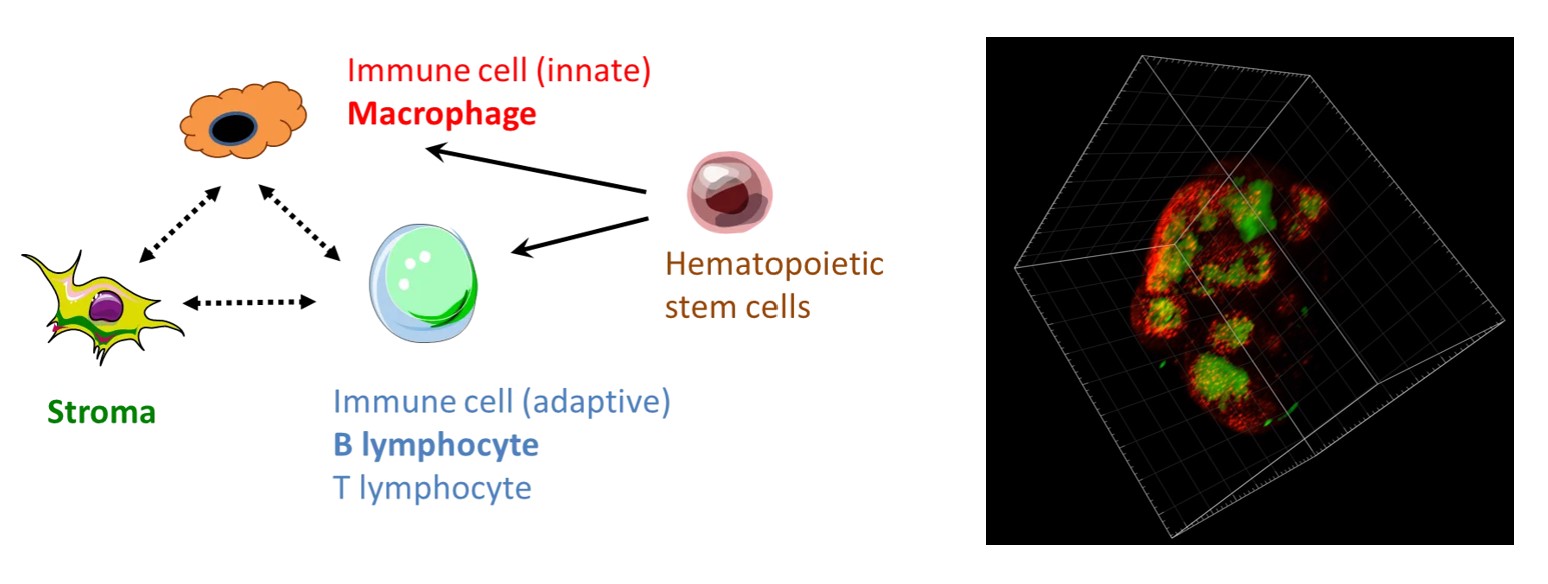
Interactions du microenvironnement immun dans la santé et les pathologies
Nous recherchons à comprendre comment les interactions immuno-micro-environnementales affectent la fonction des organes lymphoïdes, la peau, l’intestin et les poumons.
Ainsi, nous avons récemment montré que les cellules endothéliales lymphatiques créent une niche pour un sous-type de macrophages ganglionnaires impliqué dans la réponse immunitaire anti-pathogène et anti-cancéreuse.
Afin de modéliser les maladies chez l’homme dans un effort de médecine personnalisée, le laboratoire reconstitue des organoïdes in vitro, comme la peau humaine immun-competente et innervée. Par ailleurs, nous avons exploité l’affinité des arbovirus pour les cellules immunitaires de la peau humaine afin de générer des vecteurs ciblant les macrophages et les cellules dendritiques.
- Isolation et cultures en 2D et 3D de cellules murines et humaines primaires
et de cellules humaines neuronales dérivées des iPSCs. / Isolation and 2D + - Transparisation et microscopie à fluorescence d’organe entier
c.mueller (at) ibmc-cnrs.unistra.fr

Responsable :
Pascal Villa
Plateforme de chimie biologique intégrative de Strasbourg
PCBIS propose ses prestations de service et de recherche aux laboratoires publics et privés :
- Développement d’essais : les services « criblage à haut débit » et « ciblothèque » mettent au point et miniaturisent des essais robotisés, produisent et valident des modèles biologiques (moléculaires et cellulaires) du clonage à l’expression de protéines ou de lignées cellulaires (protéines solubles et lignées stables ou transitoires)
- Criblage à haut débit (HTS) : le service « HTS » valide et réalise les criblages robotisés de chimiothèques pour identifier des composes actifs.
- Microfluidique : le service « Microfluidique » développe des nouveaux modèles et des outils dans le but de réaliser des expériences dans des micropuces microfluidiques.
- Chimiothèques : le service » Chimiothèques » gère les collections de molecules et substances naturelles, réalise les études de relation structure-activité et contribue à l’optimisation des molécules actives.
- ADME-Tox : le service « TechmedILL » établie les profils physico-chimiques et pharmaco-cinétiques des composés (solubilité, log D, pKa, stabilité chimique et plasmatique, perméabilité membranaire, métabolisme, pK in vivo…) et la toxicité cellulaire.
- Formation : nos ingénieurs forment et supervisent les étudiants et chercheurs désirant utiliser nos technologies et laboratoires.
- Identification de candidats médicaments par des techniques innovantes de fluorescence en tests cellulaires et moléculaires miniaturisés
- Analyse des propriétés pharmacologiques et précliniques des composés
- Modèles animaux (asthme, inflammation…)

pvilla (at) unistra.fr

Responsable : Françoise Dantzer
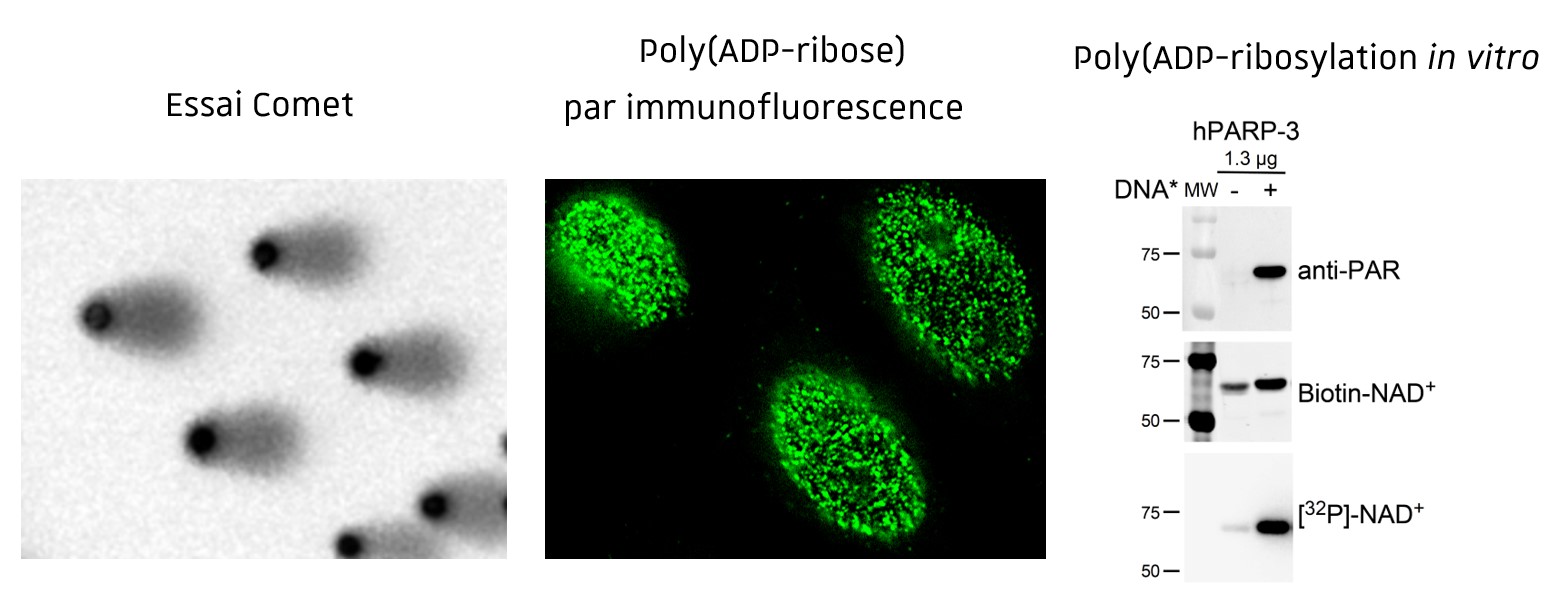
Poly(ADP-ribosyl)ation et intégrité du génome
Notre équipe a pour objectif d’élucider le rôle complexe de la réaction de poly(ADP-ribosyl)ation catalysée par les Poly(ADP-ribse) polymérases (PARPs, 17 membres) dans les mécanismes qui contrôlent la stabilité du génome, la tumorigénèse et depuis plus récemment la différenciation cellulaire.
Les travaux antérieurs de l’équipe ont notamment permis de définir PARP1 et PARP2 comme des protéines clées de la réponse cellulaire aux dommages dans l’ADN. Leur inhibition est aujourd’hui utilisée comme une stratégie thérapeutique efficace pour potentialiser l’action cytotoxique de la chimio- ou de la radiothérapie ou pour cibler des cancers déficients dans les mécanismes de réparation de l’ADN (cancers BRCA1mut).
Toutefois, les inhibiteurs actuels sont encore peu spécifiques et un enjeu majeur dans le domaine est de déterminer les propriétés biologiques des autres membres de cette famille. Dans cette idée, depuis 2011, l’équipe a développé des efforts importants visant à décortiquer les propriétés biologiques de PARP3, moins connue. Nous explorons son mécanisme d’action dans la réparation des cassures dans l’ADN et dans la progression tumorale dans le modèle des cancers du sein, des glioblastomes, du pancréas. Nous examinons sa contribution dans des évènements de différenciation cellulaire au cours de la neurogénèse et la régénération musculaire.
Nous abordons ces questions par des approches expérimentales complémentaires de biochimie, de biologie moléculaire et cellulaire et par le développement et la caractérisation phénotypique de modèles cellulaires en portant une attention particulière aux cellules souches, et des modèles animaux perte de fonction (Crispr/Cas9, souris knockout). Enfin, en collaboration avec les autres équipes membres de l’IMS, nous développons des stratégies de ciblage de la protéine par criblage de chimiothèques par anisotropie de fluorescence (D. Bonnet ; P. Vascal) et par le développement d’anticorps bi-conjuguées (A. Wagner).
Techniques d’étude de l’intégrité du génome et des mécanismes de réparation in vitro (Essais de Poly(ADP-ribosyl)ation), in cellulo (SCE, Essais Comet, Essais Tunel, cinétique des foyers gH2AX, 53BP1, BRCA1, RAD51, poly(ADP-ribose) par immunofluorescence, modèles cellulaires d’évaluation de la réparation) et in vivo (gH2AX, 53BP1, BRCA1, RAD51, poly(ADP-ribose) par immunohistochimie sur coupes de tissus).
francoise.dantzer (at) unistra.fr

Responsable : Dominique Bonnet
Chimie Biologie Intégrative et Pharmacognosie
Notre équipe appartient au Laboratoire d’Innovation Thérapeutique (UMR7200, Faculté de Pharmacie d’Illkirch) et elle est membre de l’Institut du Médicament de Strasbourg (IMS), du Pôle d’Excellence ‘Frontier Research in Chemistry’ et de l’Ecole Universitaire de Recherche interdisciplinaire sur la Douleur (EURIDOL).
- Patented “FluoroPEP” technology1.
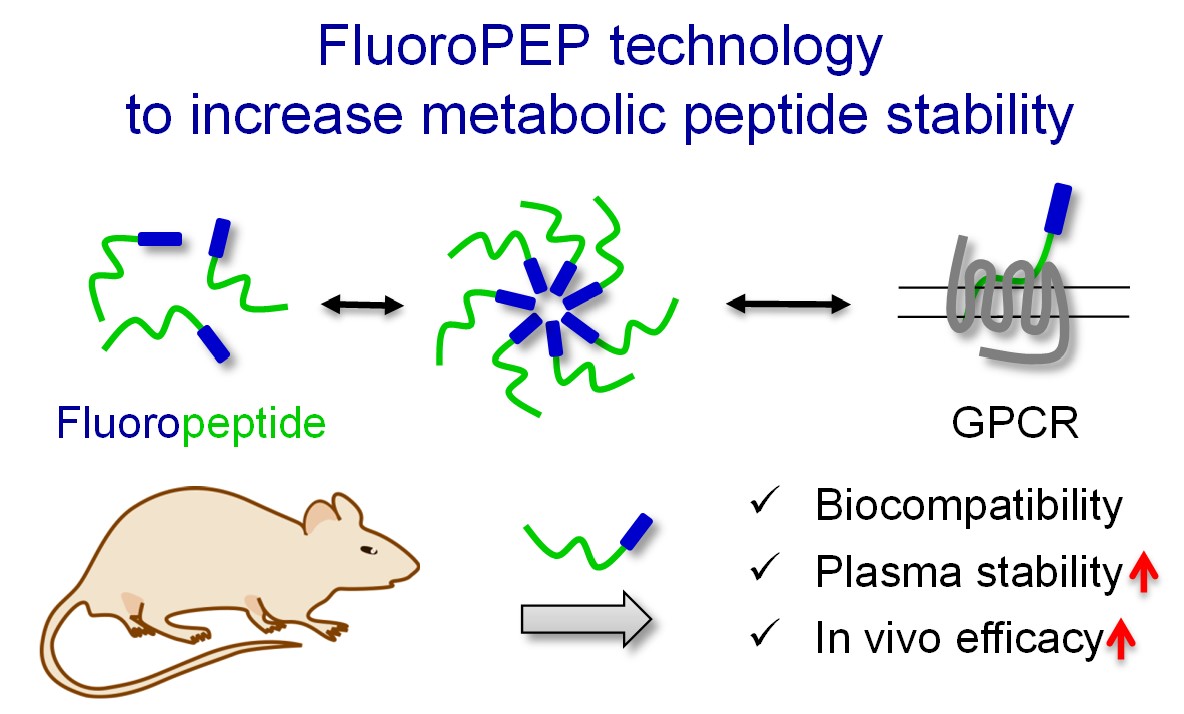 Figure. Innovative approach to increase plasmatic stability and in vivo efficacy of peptides for therapeutic applications.
References:
[1] (a) Esteoulle L.; Simonin F.; Bonnet D. Metabolically stable spexin peptide analogs. WO2017216360; 21-12-2017; (b) Iturrioz X.; Llorens-Cortes C.; Bonnet D. Metabolically stable peptide analogs. WO2017216359; 21-12-2017; (c) Iturrioz, X.; Llorens-Cortes, C.; Bonnet D. Metabolically stable apelin analogs in the treatment of disease mediated by the apelin receptor. WO2016/102648, 30-06-2016.
[2] (a) Flahault, A. et al. NatCommun., 2021, 12, 1-14; (b) Jourdain de Muizo, C. et al. ChemBioChem, 2020, 1-6; (c) Gerbier, R. et al. FASEB J., 2017, 31, 687-700.
Figure. Innovative approach to increase plasmatic stability and in vivo efficacy of peptides for therapeutic applications.
References:
[1] (a) Esteoulle L.; Simonin F.; Bonnet D. Metabolically stable spexin peptide analogs. WO2017216360; 21-12-2017; (b) Iturrioz X.; Llorens-Cortes C.; Bonnet D. Metabolically stable peptide analogs. WO2017216359; 21-12-2017; (c) Iturrioz, X.; Llorens-Cortes, C.; Bonnet D. Metabolically stable apelin analogs in the treatment of disease mediated by the apelin receptor. WO2016/102648, 30-06-2016.
[2] (a) Flahault, A. et al. NatCommun., 2021, 12, 1-14; (b) Jourdain de Muizo, C. et al. ChemBioChem, 2020, 1-6; (c) Gerbier, R. et al. FASEB J., 2017, 31, 687-700.
- Patented “Turn-ON” technology1.
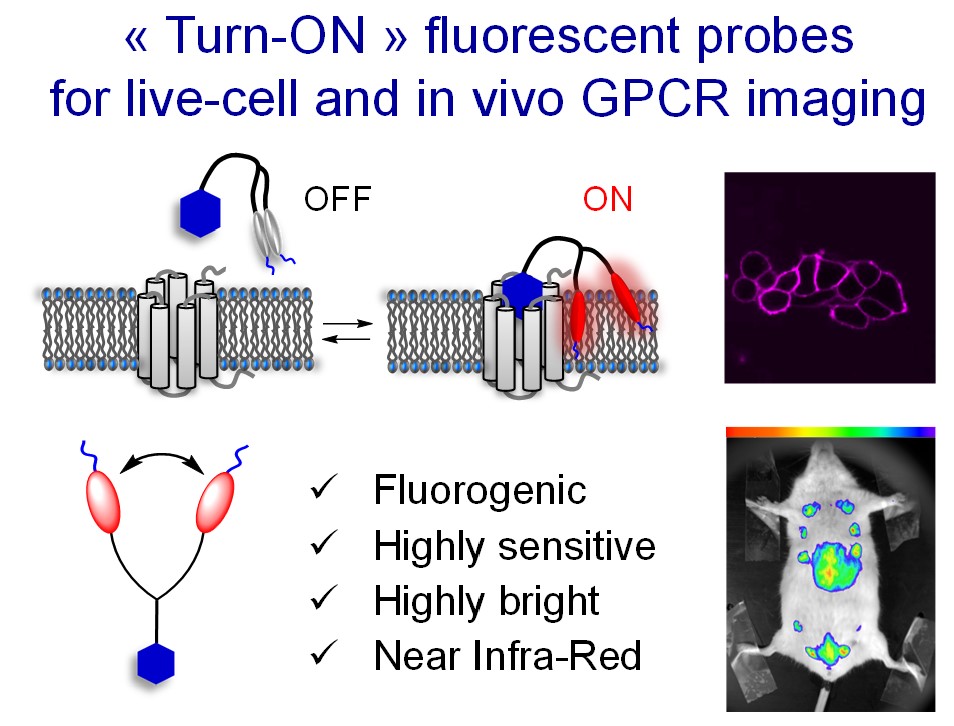 Figure. New concept of fluorogenic dimer ligands for the background-free fluorescence imaging of GPCR.
References:
[1] Karpenko, I.; Collot, M.; Klymchenko, A.; Bonnet, D. EP20305479.6, 12-05-2020
[2] Karpenko, I.A. et al. J. Am. Chem. Soc., 2015, 137, 405-412.
[3] Esteoulle, L. et al. Chem. Sci. 2020, 11, 6824-6829.
Figure. New concept of fluorogenic dimer ligands for the background-free fluorescence imaging of GPCR.
References:
[1] Karpenko, I.; Collot, M.; Klymchenko, A.; Bonnet, D. EP20305479.6, 12-05-2020
[2] Karpenko, I.A. et al. J. Am. Chem. Soc., 2015, 137, 405-412.
[3] Esteoulle, L. et al. Chem. Sci. 2020, 11, 6824-6829.dominique.bonnet (at) unistra.fr

Responsable : Guilhem Chaubet
Chimie Biofonctionnelle
Deux axes majeurs de recherche se dégagent ainsi : la chimie in-vivo et la conjugaison de biomolécules.
La chimie in-vivo a pour but d’effectuer une réaction chimique dans un milieu vivant.
Nos recherches actuelles dans ce domaine portent désormais sur le décryptage des règles gouvernant les vitesses de ces réactions dans différents milieux biologiques, sur la conception de réactifs ayant un tropisme pour certains organes et des temps de résidence dans l’organisme plus ou moins longs, mais également sur de nouveaux catalyseurs biocompatibles capables de transformer in vivo des molécules xénobiotiques afin de purifier l’organisme de polluants ou d’activer certaines fonctions biologiques à la demande.
Le second axe de recherche de l’équipe BFC concerne la conjugaison de biomolécules et son application à la synthèse de conjugués anticorps-médicament dans le domaine des thérapies ciblées contre le cancer.
UMR 7199 CNRS-Unistra, Laboratoire de Conception et Application de Molécules Bioactives
Faculté de pharmacie, 74 route du Rhin, 67401 Illkirch Cedex

